اسید و باز چه هستند؟تعریف ساده و علمی اسید و باز – نحوه تشخیص اسید و باز از هم
در این مقاله قصد داریم شمارا با مفهوم اسید و باز و تمام انچه که باید در رابطه با این دو بدانید اشنا کنیم.
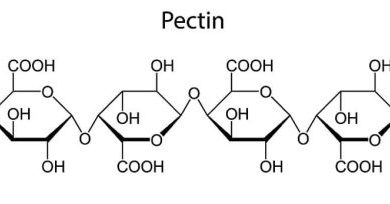
از بدن ما گرفته تا اقیانوسها و سنگهای زمین، اسیدها و بازها نقش مهمی در زندگی و محیط اطراف ما دارند. اگر طعم آب لیمو را چشیده اید یا دست های خود را با صابون شسته اید، اسیدها و بازها را تجربه کرده اید. دانشمندان مواد را بسته به ویژگی هایی مانند طعم و pH به عنوان اسید، باز (که قلیایی نیز نامیده می شود) یا خنثی طبقه بندی می کنند.
اسیدها طعم ترش دارند. از آنجایی که اسیدها می توانند به سلول ها آسیب برسانند، معده ما نیاز به پوشش ویژه ای دارد تا از آن در برابر اسید هیدروکلریک که برای هضم غذا استفاده می شود محافظت کند. ما با برخی از اسیدها آشنا هستیم – مرکبات، گوجه فرنگی و سرکه اسیدی هستند.همچنین اسم اسید ها یا باز هارا در کنار محلول های بافری شنیده اید.
اسیدها با اکثر فلزات از جمله منیزیم واکنش می دهند تا گاز هیدروژن و نمک ایجاد کنند – انواع مختلفی از نمک ها در شیمی وجود دارد. آنها همچنین با گروهی از مواد به نام کربنات واکنش نشان می دهند تا گاز دی اکسید کربن، نمک و آب تولید کنند.
باز ها ماده خورنده ماده ای است که به وسیله یک واکنش شیمیایی به سایر موادی که با آنها در تماس است آسیب می رساند یا از بین می برد.
آنها می توانند ساختار پروتئین ها را تغییر دهند. یک باز قوی می تواند باعث سوختگی شدید شیمیایی شود زیرا شروع به آسیب رساندن به پروتئین های پوست شما می کند. مواد اولیه در بسیاری از محصولات پاک کننده استفاده می شود.
تعریف اسید و باز در شیمی
اسید چیست
اسید ماده ای است که با اضافه شدن به آب یون هیدروژن (H+) تولید می کند. یون هیدروژن فقط پروتون است و الکترونی ندارد. اگر به فرمول اسیدهای مختلف نگاه کنیم، می بینیم که همه آنها حداقل یک H (هیدروژن) دارند – به عنوان مثال:
HCl – اسید هیدروکلریک
H2SO4 – اسید سولفوریک
HNO3 – اسید نیتریک.
وقتی یک مولکول اسید را در آب قرار می دهیم، از هم جدا می شود. اصطلاح علمی برای این است که آن را تجزیه می کند. به عنوان مثال اسید هیدروکلریک (HCl) به یون های هیدروژن (H+) و آنیون های کلرید (Cl-) تجزیه می شود.
تفاوت شیمیایی اسیدها و بازها در این است که اسیدها یون هیدروژن تولید می کنند و بازها یون هیدروژن را می پذیرند.
باز چیست
باز ماده ای است که اسیدها را خنثی می کند. هنگامی که بازها به آب اضافه می شوند، برای تشکیل یون های هیدروکسید که به صورت OH- نوشته می شوند، شکافته می شوند. به پایه ای که به آب اضافه شده است محلول قلیایی می گوییم.
اگر به برخی از فرمول های بازها نگاه کنیم، می بینیم که همه آنها حاوی یون های هیدروکسید (OH-) هستند – به عنوان مثال:
NaOH – هیدروکسید سدیم (سودا سوزآور)
NH4OH – محلول آمونیاک در آب
Ca(OH)2 – هیدروکسید کلسیم (آهک سازندگان)
اگر یک اسید و یک باز به هم اضافه شوند، واکنش نشان می دهند و آب (H2O) و نمک تشکیل می دهند. مثالی که ممکن است با آن آشنا باشید مسواک زدن دندان هایتان است. اسید ایجاد شده از باکتری روی دندان شما با پایه موجود در خمیر دندان شما واکنش نشان می دهد. این واکنش خنثی سازی نامیده می شود.
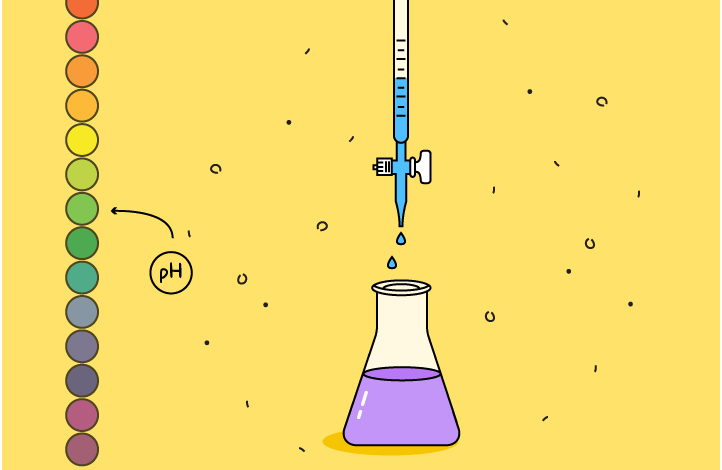
شناسایی و اندازه گیری اسیدها و بازها
PH متر میزان اسیدی یا بازی بودن محلول را اندازه گیری می کند. وقتی ماده ای را با PH متر آزمایش می کنیم، عددی از 0 تا 14 به دست می آوریم. این یک مقیاس pH است و می توان از آن برای مقایسه مواد استفاده کرد. مهم است که بدانید این مقیاس لوگاریتمی است. این به این معنی است که کاهش در مقیاس pH 1 می تواند منجر به افزایش 10 برابری غلظت یون هیدروژن شود.
اسیدها دارای pH کمتر از 7 هستند. هر چه یون های H+ بیشتر باشد اسیدی تر است و PH پایین تر خواهد بود. باز ها دارای pH بالاتر از 7 هستند. گفته می شود PH 7 خنثی است – این به این معنی است که تعادل یون های H+ و OH- وجود دارد. گاهی اوقات، مقدار pH می تواند برای اسیدهای بسیار قوی کمتر از 0 یا برای بازهای بسیار قوی بیشتر از 14 باشد.