انواع پیوند های شیمیایی در مولکول ها
انواع پیوند شیمیایی مولکول ها و اتم ها
هرآنچه که در محیط اطراف شما وجود دارد از اتم ها تشکیل شده اند. ارتباط بین اتم ها ،مولکول ها و یا یون ها و نحوه قرارگیری اتم ها درکنار یکدیگر، منجر به ایجاد مولکول ها و ساختار هایی متفاوت میشود. به این پیوند ها، پیوند های شیمیایی گفته میشود . پیوند شیمیایی ناشی از نیروی جاذبه الکترواستاتیک بین بارهای مخالف، یا بین الکترونها و هسته، یا به عنوان یک نیروی جاذبه دوقطبی است.
انواع پیوند های شیمیایی
پیوند هایی شیمیایی شامل پیوند های کووالان و غیرکووالان هستند.
پیوند کووالان:
پیوند های کووالان ساختار مولکول را تعیین میکند و قوی ترین پیوند شیمیایی است.
در پیوند کووالان اتم ها به جای انتقال الکترون ، الکترون را به اشتراک می گذارند تا به آرایش هشتایی پایدار گاز نجیب بعد از خودشان برسند که پایدارترین حالت مولکول است.
اگر اتم ها هر کدام یک الکترون به اشتراک بگذارند پیوند یگانه ؛ اگر دو الکترون به اشتراک بگذارند پیوند دوگانه و اگر هر کدام سه الکترون به اشتراک بگذارند پیوند سه گانه ایجاد می شود،هرچه الکترون بیشتری را به اشترک بگذراند پیوند پایدارتری است و برای برای از بین بردن پیوند به انرژی بیشتری نیاز است.
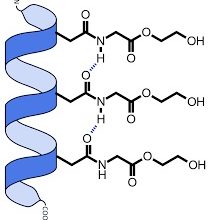
پیوند کووالانسی اغلب بین دو اتم نافلز است؛ مثلاً یک اتم کربن با چهار اتم هیدروژن چهار پیوند کووالانسی در یک مولکول به وجود میآورند .
پیوند کربن-کربن(C C) یکی از معمولترین پیوند کووالان است طول پیوند A° 1.54(آنگستروم 1A°=0.1nm) و انرژی پیوند برابربا KJ mol-1356(85Kcal mol-1) است.
به دلیل قوی بودن پیوند کووالان، برای شکستن آنها به انرژی زیادی نیاز است.
پیوند غیر کووالان:
پیوند های غیر کووالان اصولا ضعیف تر از پیوند کووالان اند اما برای فرایند های زیستی بسیار مهم اند.
-
پیوند یونی
پیوند یونی نوعی از پیوند شیمیایی است که جاذبه الکترواستاتیک بین دو یون با بار ناهمنام را شامل میشود و به عنوان برهمکنش اصلی در ترکیبات یونی به شمار میآید.
در پیوند یونی، انتقال کامل الکترونهای از لایه ظرفیت یک اتم به اتم دیگر که هردو اتم به آرایش هشت تایی پایدار میرسد و اتم گیرنده الکترون بار منفی و اتم دهنده الکترون بار مثبت پیدا میکند که در این حالت میانکنش الکترواستاتیک بین دو اتم به وجود میاید و باعث کنار هم قرار گرفتن دو اتم در کنار هم میشود.
انرژی این میانکنش را میتوان از طریق قانون کولن به دست آورد.
-
پیوند هیدروژنی
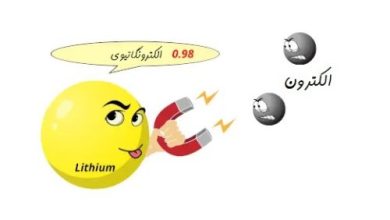
پيوند هيدروژنی بین اتمهای هیدروژن و اتمهایی که الکترونگاتیوی بالایی دارند شکل میگیرد.
پيوند هيدروژنی در واقع يک برهمکنش غير کووالانسی بين يک دهنده پروتون و يک پذيرنده پروتون در همان مولکول يا مولکول ديگر مي شود.
این پیوند نیز مثل پیوند یونی یک نوع میانکنش الکترواستاتیک است.پیوند هیدروژنی بیشتر بین دو اتم نسبتا الکترونگاتیو مثل اکسیژن و یا نتیتروژن قرار میگیرد،اتم الکترونگاتیو که با پیوند کوالان به اتم هیدروژن متصل است باعث میشود که چگالی الکترونی از اتم هیدروژن دور گردد و اتم هیدورژن داراری بار مثبت جزیی شود و از طریق میانکنش الکترواستاتیک اتم دارای جزی بار مثبت را جذب کند.
در طبیعت نیز، پیوند هیدروژنی متمایزترین و حیاتیترین نوع پیوند بین مولکولی است. تمام خواص شگفتانگیز فیزیکی آب، از پیوند هیدروژنی میان مولکولهای آب سرچشمه میگیرد
-
پیوند واندروالس
اساس پیوند واندوالس از انجاست که توزیع بار الکتریکی پیرامون یک اتم در طی یک لحظه متقارن نیست و عدم تقارن بار باعث به وجود آمدن لحظه ای جاذبه ای بین دو اتم میشود و دو اتم به سمت هم جذب میشود .