بافر چیست -چه نقشی دارد و از چه اجزایی تشکیل شده
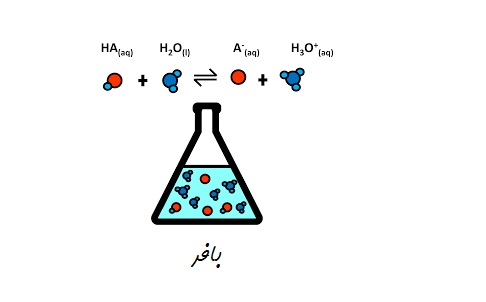
بافر محلول بسیار مفیدی است که در شیمی اسید باز استفاده می شود. گاهی اوقات، هنگامی که محلول ها با اسید یا باز قوی مخلوط می شوند، pH می تواند به سرعت و به طور چشمگیری تغییر کند. یک محلول بافر به خنثی کردن مقداری از اسید یا باز اضافه شده کمک می کند تا PH به تدریج و کمتر تغییر کند. این امر با تشکیل اجزایی حاصل میشود که با یونهای هیدروژن یا هیدروکسید واکنش نشان میدهند به طوری که نمیتوانند در حداکثر ظرفیت روی pH تأثیر بگذارند.
محلول های بافر محدودیت هایی برای خنثی سازی دارند. هنگامی که این بافر به ظرفیت خود برسد، محلول به گونه ای عمل می کند که گویی بافری وجود ندارد و pH می تواند یک بار دیگر به طور چشمگیری تغییر کند.
تجزیه و تحلیل و آزمایش با اسیدها و بازهای قوی با استفاده از بافرها آسان تر می شود. سیستم بافر بیو کربنات که برای تنظیم pH خون استفاده می شود، نمونه ای از استفاده واقعی از بافر است.
محلول بافر محلولی است که قادر است غلظت یون هیدروژن (pH) خود را تنها با تغییرات جزئی در رقت یا افزودن مقدار کمی اسید یا باز حفظ کند. محلولهای بافر در تخمیر، نگهدارندههای غذا، دارورسانی، آبکاری، چاپ، فعالیت آنزیمها، ظرفیت حمل اکسیژن خون به غلظت یون هیدروژن خاص (pH) استفاده میشود.
محلول های اسید ضعیف و باز مزدوج یا باز ضعیف و اسید مزدوج آن قادر به حفظ pH بوده و محلول های بافری هستند.
اجزای یک محلول بافر
یک بافر باید دارای یکی از دو گزینه باشد: اسید ضعیف و باز مزدوج آن یا باز ضعیف و اسید مزدوج آن. نحوه انتخاب اجزا با pH مورد نظر محلول ارتباط دارد.
یک بافر اسیدی دارای pH کمتر از 7 است. این محلول ها با اسید ضعیف و باز مزدوج آن به صورت نمک ساخته می شوند. اگر می خواهید PH محلول را تغییر دهید، می توانید نسبت اسید و نمک را تغییر دهید. علاوه بر این، اسیدهای مختلف (همراه با نمک های مزدوج آنها) می توانند به روش های مختلف بر pH تأثیر بگذارند.
بافر اسیدی
اسید استیک و استات سدیم نمونه ای از اسید ضعیف و نمک مزدوج آن است. تعادل اسیدی به سمت چپ می رود. با این حال، اگر استات سدیم اضافه کنید، یون های استات به محلول اضافه می شوند. با توجه به اصل Le Chatelier، تعادل به سمت چپ تغییر می کند.
CH3COOH(aq) ⇄ CH3COO–(aq) + H+(aq)
افزودن اسید به بافر اسیدی
با در نظر گرفتن نمونه بافر بالا، اگر اسید اضافه شود چه اتفاقی می افتد؟ بافر باید برای حذف یون های هیدروژن از اسید ورودی کار کند. یون های استات با این یون های هیدروژن ترکیب می شوند و اسید استیک ایجاد می کنند. از آنجایی که اسید استیک یک اسید ضعیف است، واکنش می تواند یون های هیدروژن را سریعتر از اسید استیک جدا کند. به همین دلیل است که pH به طور چشمگیری تغییر نمی کند.
افزودن باز به بافر اسیدی
مجدداً، بیایید محلول بافر از بالا را در نظر داشته باشیم. افزودن پایه برای تعامل با این بافر کمی پیچیده تر است. اسید استیک با یون هیدروکسید از پایه که باعث تشکیل یون های استات، همراه با آب می شود، تعامل خواهد داشت. از آنجایی که یون های هیدروکسید از این قسمت حذف می شوند، باعث افزایش pH نمی شوند. علاوه بر این، یون های هیدروژن اضافی حاصل از تفکیک اسید استیک نیز می توانند با هیدروکسید ترکیب شوند و آب را تشکیل دهند. با این روشها، بیشتر یونهای هیدروکسید با یونهای هیدروژن برهمکنش میکنند تا حضور اصلی را حذف کنند، اما به اندازه کافی برای تغییر شدید pH نیستند.
بافر بازی (قلیایی)
یک بافر بازی دارای pH بیشتر از 7 است. این محلول ها از یک باز ضعیف و اسید مزدوج آن به صورت نمک ساخته می شوند. غلظت هر دو جزء باید برای شروع برابر باشد. با این حال، مانند بافرهای اسیدی، می توانید pH محلول را با تغییر نسبت بین نمک پایه و اسیدی تغییر دهید.
آمونیاک و کلرید آمونیوم نمونه ای از یک باز ضعیف با اسید مزدوج آن است. تعادل به سمت چپ می رود. با این حال، اگر کلرید آمونیوم اضافه کنید، یون های آمونیوم به محلول اضافه می شوند. این بار، اصل Le Chatelier باعث می شود که تعادل حتی بیشتر به سمت چپ حرکت کند.
NH3(aq) + H2O(l) ⇄ NH4+(aq) + OH–(aq)
افزودن اسید به بافر بازی
با در نظر گرفتن نمونه بافر بالا، بیایید تجزیه و تحلیل کنیم که اگر اسید اضافه شود چه اتفاقی می افتد. هیدروژن اسید اضافه شده با آمونیاک برهمکنش می کند و یون های آمونیوم را تشکیل می دهد. این باعث حذف بسیاری از یون های هیدروژن می شود. علاوه بر این، به دلیل واکنش بین آمونیاک و آب، مقداری یون هیدروکسید در محلول وجود دارد. این یون های هیدروکسید با هیدروژن های اسیدی برهم کنش می کنند تا آب بیشتری را تشکیل دهند. این روشها باعث حذف بیشتر یونهای هیدروژن برای حذف حضور اسیدی میشوند که به باریک کردن تغییر pH کمک میکند.