بررسی دقیق ساختار های اول تا چهارم پروتئین و ویژگی های انها
آیا تا به حال فکر کرده اید که چرا وقتی یک تخم مرغ را سرخ می کنید، سفیده تخم مرغ از حالت شفاف به مات تبدیل می شود؟ اگر چنین است، این بخش برای شما مناسب است!
سفیده تخم مرغ حاوی مقادیر زیادی پروتئین به نام آلبومین است و آلبومین ها معمولاً به لطف پیوندهایی که بین اسیدهای آمینه مختلف در پروتئین ایجاد می شود، شکل سه بعدی خاصی دارند.
گرما باعث شکسته شدن این پیوندها می شود و اسیدهای آمینه آبگریز (متنفر از آب) را که معمولاً در داخل پروتئین نگهداری می شوند در معرض دید قرار می دهد
آمینو اسیدهای آبگریز، که سعی می کنند از آب اطراف خود در سفیده تخم مرغ دور شوند، به یکدیگر می چسبند و یک شبکه پروتئینی تشکیل می دهند که ساختار سفیده تخم مرغ را در حالی که سفید و مات می شود،شکل می دهد. برای یک صبحانه خوشمزه دیگر!
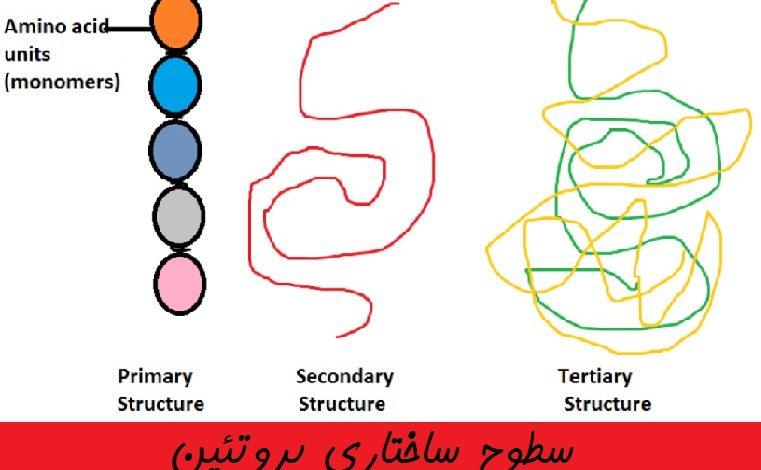
همانطور که میدانید، شکل پروتئین برای عملکرد آن بسیار مهم است. برای درک اینکه چگونه یک پروتئین شکل یا ترکیب نهایی خود را به دست می آورد، باید چهار سطح ساختاری پروتئین را درک کنیم: اولیه، ثانویه، سوم و چهارم.
ساختار اول پروتئین
ساده ترین سطح ساختار پروتئین، ساختار اولیه، به سادگی توالی اسیدهای آمینه در یک زنجیره پلی پپتیدی است.
به عنوان مثال، هورمون انسولین دارای دو زنجیره پلی پپتیدی A و B است که در شکل زیر نشان داده شده است. (مولکول انسولین نشان داده شده در اینجا انسولین گاو است، اگرچه ساختار آن شبیه به انسولین انسانی است.)
هر زنجیره مجموعه ای از اسیدهای آمینه خاص خود را دارد که به ترتیب خاصی مونتاژ شده اند. به عنوان مثال، توالی زنجیره A با گلیسین در انتهای N شروع می شود و با آسپاراژین در انتهای C به پایان می رسد و با دنباله زنجیره B متفاوت است.
توالی یک پروتئین توسط DNA ژنی که پروتئین را کد می کند (یا قسمتی از پروتئین را برای پروتئین های چند زیر واحدی کد می کند) تعیین می شود. تغییر در توالی DNA ژن ممکن است منجر به تغییر در توالی اسید آمینه پروتئین شود. حتی تغییر تنها یک اسید آمینه در توالی پروتئین می تواند بر ساختار و عملکرد کلی پروتئین تأثیر بگذارد.
به عنوان مثال، یک تغییر اسید آمینه منفرد با کم خونی سلول داسی شکل، یک بیماری ارثی که گلبول های قرمز را تحت تاثیر قرار می دهد، مرتبط است. در کم خونی داسی شکل، یکی از زنجیره های پلی پپتیدی تشکیل دهنده هموگلوبین، پروتئینی که اکسیژن را در خون حمل می کند، تغییر توالی جزئی دارد.
ساختار دوم یا ثانویه پروتئین
سطح بعدی ساختار پروتئین، ساختار ثانویه، به ساختارهای چین خورده محلی اشاره دارد که در یک پلی پپتید به دلیل برهمکنش بین اتم های ستون پلی پپتید تشکیل می شوند.
رایجترین انواع ساختارهای ثانویه مارپیچ α و ورقه چیندار β هستند. اساسا هر دو ساختار توسط پیوندهای هیدروژنی شکل می گیرند که بین کربونیل O یک اسید آمینه و آمینو H اسید آمینه دیگر تشکیل می شود.
در یک مارپیچ α، کربونیل (C=O) یک آمینو اسید به آمینو H (N-H) یک اسید آمینه که چهار زنجیره در پایین تر است پیوند هیدروژنی دارد. (به عنوان مثال، کربونیل اسید آمینه 1 یک پیوند هیدروژنی با N-H اسید آمینه 5 ایجاد می کند.)
این الگوی پیوند زنجیره پلی پپتیدی را به ساختار مارپیچی می کشد که شبیه یک نوار پیچ خورده است و هر چرخش مارپیچ حاوی 3.6 آمینو است. اسیدها گروههای R آمینو اسیدها از مارپیچ α به بیرون میچسبند، جایی که آزادانه برهم کنش دارند.
در یک ورقه β، دو یا چند بخش از یک زنجیره پلی پپتیدی در کنار یکدیگر قرار می گیرند و ساختار ورقه مانندی را تشکیل می دهند که توسط پیوندهای هیدروژنی به هم متصل می شوند. پیوندهای هیدروژنی بین گروههای کربونیل و آمینو ستون امینو اسید تشکیل میشوند، در حالی که گروههای R در بالا و پایین صفحه گسترش مییابند.
رشته های یک ورقه چین دار β ممکن است موازی باشند، در یک جهت باشند (به این معنی که انتهای N و C آنها مطابقت دارند)، یا ضد موازی، در جهات مخالف باشند (به این معنی که انتهای N یک رشته بعد قرار دارد. به C-پایانه دیگری).
ساختار سوم پروتئین
ساختار کلی سه بعدی یک پلی پپتید ساختار سوم آن نامیده می شود. ساختار سوم در درجه اول به دلیل برهمکنش بین گروه های R آمینو اسیدهایی است که پروتئین را می سازند.
برهمکنشهای گروه R که به ساختار سوم کمک میکنند شامل پیوند هیدروژنی، پیوند یونی، برهمکنشهای دوقطبی-دوقطبی، و نیروهای پراکندگی لندن – اساساً، پیوندهای غیرکووالانسی است.
برای مثال، گروههای R با بارهای مشابه یکدیگر را دفع میکنند، در حالی که آنهایی که بارهای مخالف دارند میتوانند یک پیوند یونی تشکیل دهند. به طور مشابه، گروه های قطبی R می توانند پیوندهای هیدروژنی و سایر برهمکنش های دوقطبی-دوقطبی را تشکیل دهند.
همچنین برای ساختار سوم، برهمکنشهای آبگریز مهم هستند، که در آن اسیدهای آمینه با گروههای غیرقطبی و آبگریز R در داخل پروتئین با هم جمع میشوند و اسیدهای آمینه آبدوست را در خارج میگذارند تا با مولکولهای آب اطراف تعامل کنند.
در نهایت، یک نوع خاص از پیوند کووالانسی وجود دارد که می تواند به ساختار سوم کمک کند: پیوند دی سولفید. پیوندهای دی سولفید، پیوندهای کووالانسی بین زنجیرههای جانبی حاوی گوگرد سیستئینها، بسیار قویتر از سایر انواع پیوندهایی هستند که به ساختار سوم کمک میکنند.
پیوندهای دی سولفید مانند سنجاق های مولکولی عمل می کنند و قسمت هایی از پلی پپتید را محکم به یکدیگر متصل می کنند.
ساختار چهارم پروتئین
بسیاری از پروتئین ها از یک زنجیره پلی پپتیدی منفرد تشکیل شده اند و فقط سه سطح ساختار دارند. با این حال، برخی از پروتئین ها از چندین زنجیره پلی پپتیدی ساخته شده اند که به عنوان زیر واحد نیز شناخته می شوند. وقتی این زیرواحدها به هم می رسند، به پروتئین ساختار چهارتایی می دهند.
ما قبلاً با نمونه ای از پروتئین با ساختار چهارتایی مواجه شده ایم: هموگلوبین. همانطور که قبلاً ذکر شد، هموگلوبین اکسیژن را در خون حمل می کند و از چهار زیرواحد، دو زیر واحد از نوع α و β تشکیل شده است. نمونه دیگر DNA پلیمراز است، آنزیمی که رشته های جدیدی از DNA را سنتز می کند و از ده زیر واحد تشکیل شده است.
به طور کلی، همان نوع برهمکنشهایی که به ساختار سوم کمک میکنند (عمدتاً برهمکنشهای ضعیف، مانند پیوند هیدروژنی و نیروهای پراکندگی لندن) نیز زیرواحدها را کنار هم نگه میدارند تا ساختار چهارتایی ایجاد کنند.
تصویر زیر ساختار های اول تا چهارم پروتئین ها را به خوبی نمایش میدهد:






مرسی عالی بود