مارپیچ الفا چیست-ساختار دوم مارپیچ الفا درپروتئین
مارپیچ الفا چیست؟ بررسی ساختار دوم الفا هلیکس در پروتئین ها
مارپیچ آلفا یک ساختار ثانویه در پروتئین ها است که در آن زنجیره پلی پپتیدی مانند یک مارپیچ خمیده است. پروتئین ها بخش مهمی از موجودات زنده هستند. در داخل سلول ها، پروتئین ها آنزیم هایی را می سازند که واکنش های شیمیایی را کاتالیز می کنند. آنها همچنین ساختارها را تشکیل می دهند، مواد را حمل می کنند و به تحرک سلولی، تقسیم سلولی و غیره کمک می کنند.
پروتئین ها به دلیل ساختار سه بعدی منحصربفرد خود قادر به انجام کارهای متنوعی در داخل سلول هستند. ساختار یک پروتئین توسط توالی اسید آمینه آن تعیین می شود. پروتئین ها از رشته های بلند اسیدهای آمینه به نام زنجیره های پلی پپتیدی ساخته شده اند. روشی که زنجیره های پلی پپتیدی تا می شوند و به اسیدهای آمینه اجازه می دهد تا با یکدیگر تعامل کنند، ساختار سه بعدی لازم برای عملکرد آنها را ایجاد می کند.
ساختار اولیه پروتئین، توالی اسید آمینه زنجیره پلی پپتیدی است. نحوه تشکیل پیوندهای هیدروژنی توسط زنجیره پلی پپتیدی، ساختار ثانویه را تعیین می کند. دو نوع ساختار ثانویه اصلی در پروتئین ها وجود دارد، مارپیچ های آلفا و صفحات بتا. الگوی پیوند هیدروژنی اسیدهای آمینه در زنجیره پلی پپتیدی تعیین می کند که یک مارپیچ آلفا تشکیل شود یا یک صفحه بتا. زنجیره های پلی پپتیدی می توانند دارای مارپیچ های آلفا، ورقه های بتا یا هر دو باشند.
ساختار مارپیچ الفا
مارپیچ های آلفا نیز رایج ترین ساختار ثانویه در پروتئین ها هستند.برای درک چگونگی تشکیل مارپیچ آلفا، ابتدا باید ساختار اسیدهای آمینه را درک کرد. اسیدهای آمینه از یک اتم کربن مرکزی که در یک طرف به یک گروه کربونیل، یک گروه آمینه در طرف مقابل، یک اتم هیدروژن و یک زنجیره جانبی که متغیر است، ساخته شدهاند.
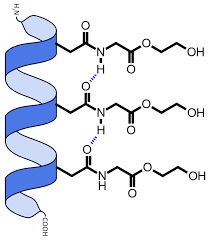
در مارپیچ های آلفا، گروه کربونیل هیدروژنی به گروه آمینو اسید آمینه ای که از آن چهار فاصله دارد، پیوند می زند. این یک الگوی مارپیچی محکم ایجاد می کند که مارپیچ آلفا را تشکیل می دهد. زنجیرههای جانبی آمینو اسیدها از مارپیچ به سمت بیرون گسترش مییابند و به آنها اجازه میدهد تا با هم تعامل داشته باشند و به تولید ساختارهای بیشتر در پروتئین کمک کنند.
لینوس پاولینگ ساختار پروتئین آلفا-مارپیچ را پیش بینی کرد. این پیش بینی زمانی تایید شد که اولین ساختار سه بعدی پروتئین میوگلوبین توسط کریستالوگرافی اشعه ایکس تعیین شد.در پروتئین آلفا مارپیچ، یک پیوند هیدروژنی بین گروه N-H به گروه C=O اسید آمینه تشکیل می شود.گروه های آلکیل زنجیره آلفا-مارپیچ در پیوندهای H دخالت ندارند اما ساختار آلفا-مارپیچ را حفظ می کنند. هر پیچ در یک مارپیچ آلفا دارای 3.6 اسید آمینه است.
همانطور که گفته شد در یک مارپیچ α، کربونیل (C=O) یک آمینو اسید به H آمینو (N-H) یک اسید آمینه که چهار زنجیره در پایین تر است پیوند هیدروژنی میدهد. (به عنوان مثال، کربونیل اسید آمینه 1 یک پیوند هیدروژنی با N-H اسید آمینه 5 ایجاد می کند.) این الگوی پیوند زنجیره پلی پپتیدی را به ساختار مارپیچی می کشد که شبیه یک نوار پیچ خورده است و هر چرخش مارپیچ حاوی 3.6 آمینو است. اسیدها گروههای R آمینو اسیدها از مارپیچ α به بیرون میچسبند، جایی که آزادانه برهم کنش دارند.
آمینو اسیدهای خاصی به طور کم و بیش در مارپیچ های α یا ورقه های β یافت می شوند. به عنوان مثال، اسید آمینه پرولین گاهی اوقات “مارپیچ شکن” نامیده می شود زیرا گروه R غیر معمول آن (که به گروه آمینه پیوند می زند و حلقه تشکیل می دهد) یک خمیدگی در زنجیره ایجاد می کند و با تشکیل مارپیچ سازگار نیست.
پرولین به طور معمول در خم ها، مناطق بدون ساختار بین ساختارهای ثانویه یافت می شود. به طور مشابه، اسیدهای آمینه مانند تریپتوفان، تیروزین و فنیل آلانین که ساختارهای حلقه ای بزرگی در گروه های R خود دارند، اغلب در ورقه های چین دار β یافت می شوند، شاید به این دلیل که ساختار ورقه چین دار β فضای زیادی را برای زنجیره های جانبی فراهم می کند.
بسیاری از پروتئین ها دارای هر دو مارپیچ α و ورقه های چین دار β هستند، اگرچه برخی از آنها فقط یک نوع ساختار ثانویه دارند (یا هیچ کدام از آنها را تشکیل نمی دهند).